赢迪文献分享 | 以G蛋白偶联受体为靶点的多肽药物研发
2020-05-06 14:20 点击:
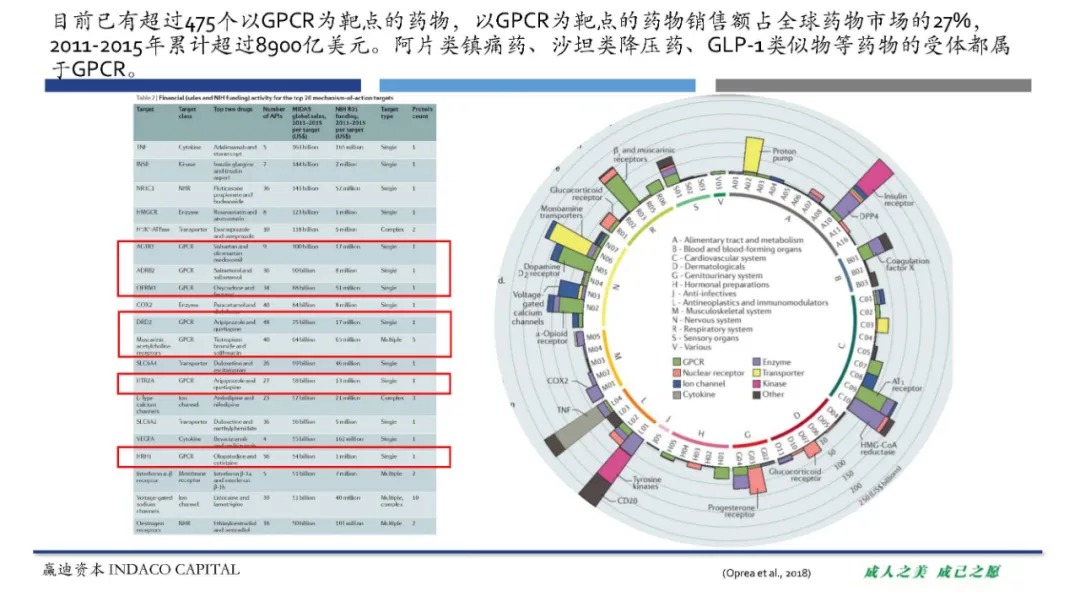
G蛋白偶联受体(G Protein-Coupled Receptors, GPCRs)是人体内最大的一类蛋白家族。GPCR广泛参与生理过程的调控,与多种疾病相关,且结构上有结合口袋,是很好的成药位点。目前已有超过475种以GPCR为靶点的药物获批上市,销售额占整体药物市场的27%。
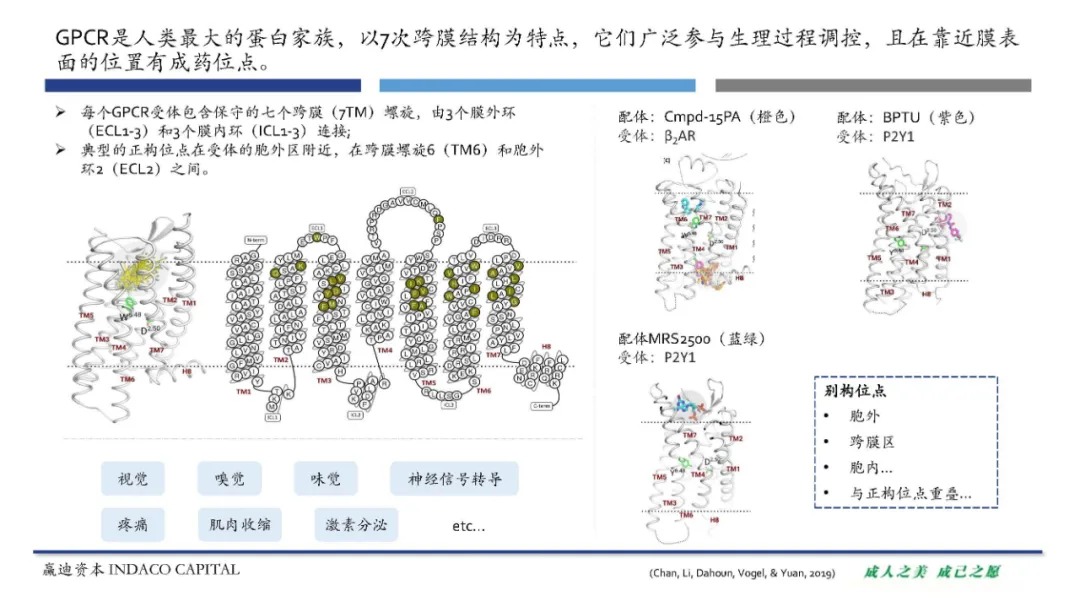
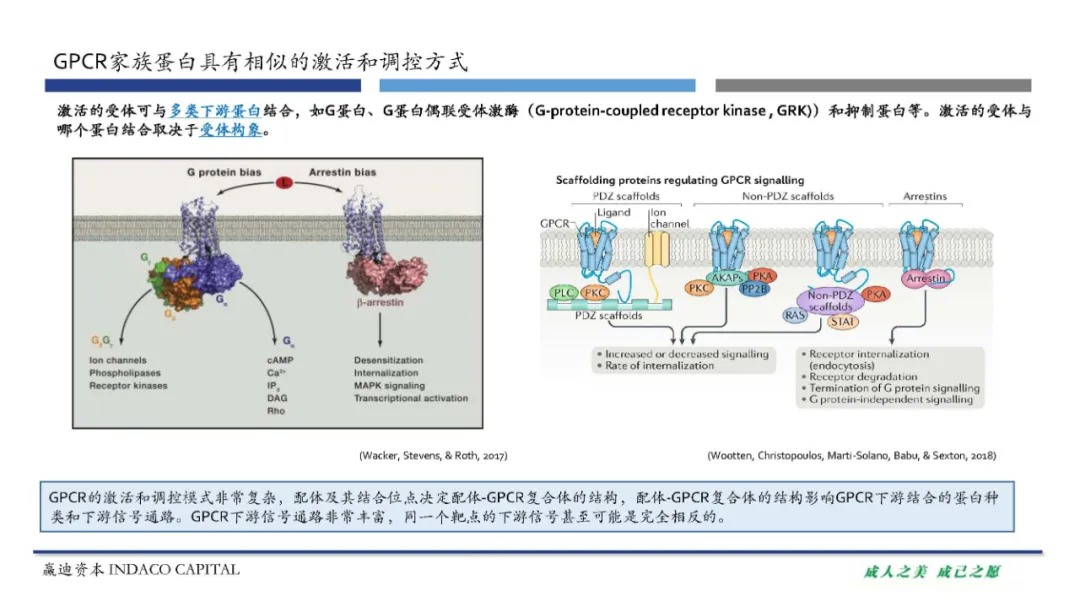
GPCR是7次跨膜蛋白,该类蛋白有着相似的调控方式。GPCR受到胞外配体的激活,从而发生构象改变,引发下游信号通路,通过第二信使等对生理过程进行调控。GPCR下游结合蛋白以G蛋白为主,但也存在非G蛋白依赖的信号通路,可以直接和G蛋白偶联受体激酶(G-protein-coupled receptor kinase , GRK)和抑制蛋白相结合。G蛋白也存在多种亚型,GPCR与不同蛋白结合将介导不同的下游信号通路。
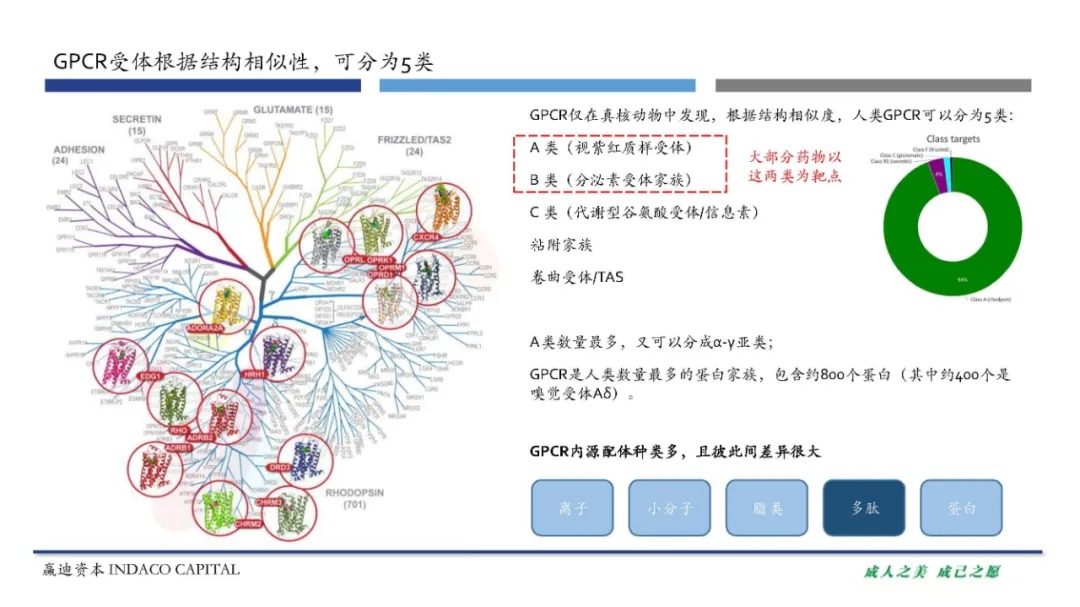
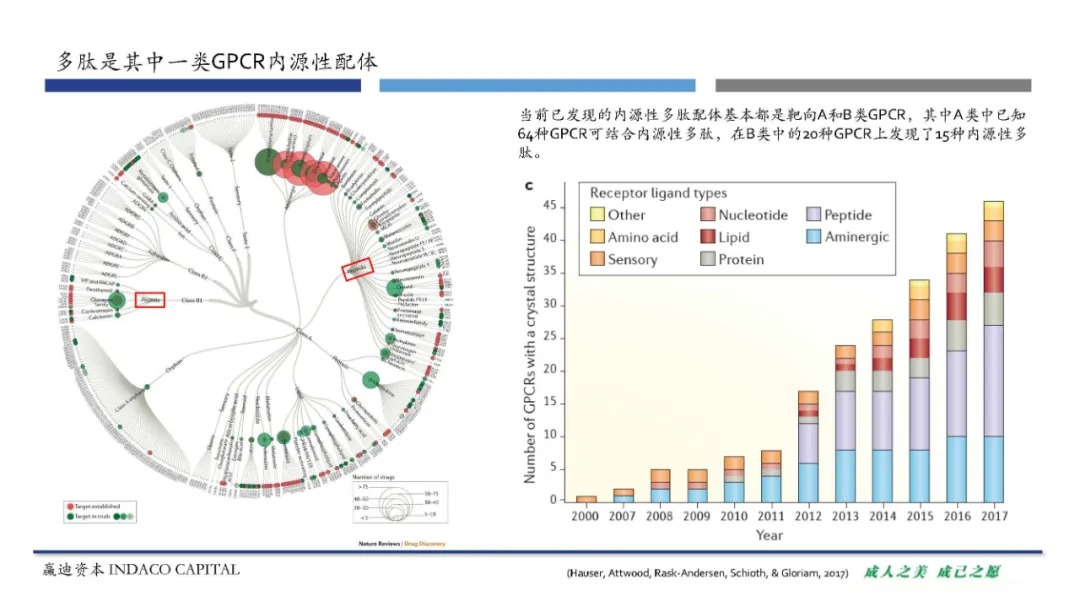
根据结构相似度,人类GPCR可以分为5类:A 类(视紫红质样受体)、B 类(分泌素受体家族)、C 类(代谢型谷氨酸受体/信息素)、粘附家族和卷曲受体/TAS。大部分成药靶点都属于A类和B类。GPCR的内源性配体有很多种类,包括离子、小分子、脂类、多肽、蛋白等。当前已发现的内源性多肽配体基本都是靶向A和B类GPCR,其中A类中已知64种GPCR可结合内源性多肽,在B类中的20种GPCR上发现了15种内源性多肽。目前已有将近50种靶向GPCR的多肽类药物上市,以GPCR的内源性多肽配体及其修饰后的衍生物为主。最近获批的多肽类药物提示我们,研发靶向GPCR的多肽类药物时,配体的构象偏好性可能对药物有效性产生影响。目前的研发趋势包括:对多肽药物进行修饰,增加半衰期、优化给药方式;用稳定性高的多肽分子靶向分布在肠道表层的GPCR,开发口服多肽类药物;还可以通过开发多肽类药物,避免CNS不良反应。未来G蛋白偶联受体多肽药物的研发思路,主要包括改善效力、半衰期和给药方式,以及利用配体-受体信号偏好和结构研究得到的信息来进行药物优化。
总体来说,以GPCR为靶点进行药物研发难度较大,与其他药物研发相比,涉及一些特殊环节。如GPCR蛋白的表达、纯化及药物筛选技术等都是成药中仍需解决的问题。越来越多的公司在这些方面进行布局,开发了一系列新技术。总体上,靶向GPCR的多肽药物研发是很有希望的方向。





















参考资料:
1. Chan, H. C. S., Li, Y., Dahoun, T., Vogel, H., & Yuan, S. (2019). New Binding Sites, New Opportunities for GPCR Drug Discovery. Trends Biochem Sci, 44(4), 312-330. doi:10.1016/j.tibs.2018.11.011
2. Cheloha, R. W., Gellman, S. H., Vilardaga, J. P., & Gardella, T. J. (2015). PTH receptor-1 signalling-mechanistic insights and therapeutic prospects. Nat Rev Endocrinol, 11(12), 712-724. doi:10.1038/nrendo.2015.139
3. Cruz, A., Domingos, S., Gallardo, E., & Martinho, A. (2017). A unique natural selective kappa-opioid receptor agonist, salvinorin A, and its roles in human therapeutics. Phytochemistry, 137, 9-14. doi:10.1016/j.phytochem.2017.02.001
4. Hauser, A. S., Attwood, M. M., Rask-Andersen, M., Schioth, H. B., & Gloriam, D. E. (2017). Trends in GPCR drug discovery: new agents, targets and indications. Nat Rev Drug Discov, 16(12), 829-842. doi:10.1038/nrd.2017.178
5. Hilger, D., Masureel, M., & Kobilka, B. K. (2018). Structure and dynamics of GPCR signaling complexes. Nat Struct Mol Biol, 25(1), 4-12. doi:10.1038/s41594-017-0011-7
6. Manglik, A., Lin, H., Aryal, D. K., McCorvy, J. D., Dengler, D., Corder, G., . . . Shoichet, B. K. (2016). Structure-based discovery of opioid analgesics with reduced side effects. Nature, 537(7619), 185-190. doi:10.1038/nature19112
7. Oprea, T. I., Bologa, C. G., Brunak, S., Campbell, A., Gan, G. N., Gaulton, A., . . . Zahoranszky-Kohalmi, G. (2018). Unexplored therapeutic opportunities in the human genome. Nat Rev Drug Discov, 17(5), 317-332. doi:10.1038/nrd.2018.14
8. Pavlos, N. J., & Friedman, P. A. (2017). GPCR Signaling and Trafficking: The Long and Short of It. Trends Endocrinol Metab, 28(3), 213-226. doi:10.1016/j.tem.2016.10.007
9. Rao, S. S. C. (2018). Plecanatide: a new guanylate cyclase agonist for the treatment of chronic idiopathic constipation. Therap Adv Gastroenterol, 11, 1756284818777945. doi:10.1177/1756284818777945
10. Wacker, D., Stevens, R. C., & Roth, B. L. (2017). How Ligands Illuminate GPCR Molecular Pharmacology. Cell, 170(3), 414-427. doi:10.1016/j.cell.2017.07.009
11. Wootten, D., Christopoulos, A., Marti-Solano, M., Babu, M. M., & Sexton, P. M. (2018). Mechanisms of signalling and biased agonism in G protein-coupled receptors. Nat Rev Mol Cell Biol, 19(10), 638-653. doi:10.1038/s41580-018-0049-3
文章转载自-----微信公众号“嬴迪资本”文章《赢迪文献分享 | 以G蛋白偶联受体为靶点的多肽药物研发》
GPCR是7次跨膜蛋白,该类蛋白有着相似的调控方式。GPCR受到胞外配体的激活,从而发生构象改变,引发下游信号通路,通过第二信使等对生理过程进行调控。GPCR下游结合蛋白以G蛋白为主,但也存在非G蛋白依赖的信号通路,可以直接和G蛋白偶联受体激酶(G-protein-coupled receptor kinase , GRK)和抑制蛋白相结合。G蛋白也存在多种亚型,GPCR与不同蛋白结合将介导不同的下游信号通路。
根据结构相似度,人类GPCR可以分为5类:A 类(视紫红质样受体)、B 类(分泌素受体家族)、C 类(代谢型谷氨酸受体/信息素)、粘附家族和卷曲受体/TAS。大部分成药靶点都属于A类和B类。GPCR的内源性配体有很多种类,包括离子、小分子、脂类、多肽、蛋白等。当前已发现的内源性多肽配体基本都是靶向A和B类GPCR,其中A类中已知64种GPCR可结合内源性多肽,在B类中的20种GPCR上发现了15种内源性多肽。目前已有将近50种靶向GPCR的多肽类药物上市,以GPCR的内源性多肽配体及其修饰后的衍生物为主。最近获批的多肽类药物提示我们,研发靶向GPCR的多肽类药物时,配体的构象偏好性可能对药物有效性产生影响。目前的研发趋势包括:对多肽药物进行修饰,增加半衰期、优化给药方式;用稳定性高的多肽分子靶向分布在肠道表层的GPCR,开发口服多肽类药物;还可以通过开发多肽类药物,避免CNS不良反应。未来G蛋白偶联受体多肽药物的研发思路,主要包括改善效力、半衰期和给药方式,以及利用配体-受体信号偏好和结构研究得到的信息来进行药物优化。
总体来说,以GPCR为靶点进行药物研发难度较大,与其他药物研发相比,涉及一些特殊环节。如GPCR蛋白的表达、纯化及药物筛选技术等都是成药中仍需解决的问题。越来越多的公司在这些方面进行布局,开发了一系列新技术。总体上,靶向GPCR的多肽药物研发是很有希望的方向。